Geles de proteínas vegetales y polisacáridos como sistema de transporte en alimentos: una revisión narrativa breve[1]
Vegetable protein gels and polysaccharides as transport systems in food: a short narrative review
Géis de proteínas vegetais e polisacarídeos como sistemas de transporte em alimentos: uma breve revisão narrativa
Marcela Jarpa-Parra
Universidad Adventista de Chile
![]() https://orcid.org/0000-0003-2104-7628
https://orcid.org/0000-0003-2104-7628
Recibido: 27-06-2023
Aceptado: 5-12-2023
Cómo citar este documento:
Jarpa-Parra, M. (2023). Geles de proteínas vegetales y polisacáridos como sistema de transporte en alimentos: una revisión narrativa breve. Revista Científica Cuadernos de Investigación, 1, e20, 1-16. https://cuadernosdeinvestigacion.unach.cl/index.php/rcci/article/view/e20
Resumen
Esta revisión estudia brevemente los sistemas de transporte de nutrientes y bioactivos en alimentos mediante la formación de microcápsulas a partir de geles de proteína-polisacárido. Aunque estos sistemas son prometedores debido a la liberación controlada de activos y la protección de ingredientes sensibles, entre otras, presentan limitaciones y aspectos negativos que deben abordarse. La producción de microcápsulas basadas en geles de proteínas vegetales y polisacáridos se basa principalmente en sistemas de coacervados o complejos de estos polímeros. Entre sus principales ventajas se cuenta el ser una alternativa relevante por ser materiales económicos, con propiedades tecno-funcionales adecuadas y de bajo riesgo para la salud humana cuando se diseñan correctamente. Sin embargo, uno de los principales desafíos es garantizar su estabilidad. Las condiciones de proceso vuelven las mezclas inestables, afectando su eficacia y solubilidad, lo que resulta en la liberación temprana de los bioactivos quedando desprotegidos durante el paso por el tracto gastrointestinal y en almacenamiento. Se han utilizado técnicas de reticulación, gelificación en frío y modificación de la superficie de las microcápsulas que mejoran la estabilidad mecánica y su resistencia a la erosión, pero algunos compuestos utilizados son tóxicos y difíciles de eliminar, limitando su aplicación en alimentos y haciéndolos inseguros. A pesar de los avances realizados, todavía hay aspectos que deben abordarse para mejorar las propiedades funcionales de estos geles y microcápsulas. La investigación continúa buscando soluciones que permitan su aplicación segura y efectiva en alimentos.
Palabras clave: proteínas, geles, polisacáridos, alimentos, microcápsulas.
Abstract
This review studies the transport systems of nutrients and bioactive in foods by forming microcapsules from protein-polysaccharide gels. Although promising, they have limitations and negative aspects that must be addressed. One of the main challenges is to guarantee the stability of the microcapsules. The process conditions make the mixtures unstable, affecting their efficacy and solubility, which results in the early release of bioactive, leaving them unprotected during passage through the gastrointestinal tract and in storage. Crosslinking, cold gelling, and surface modification techniques have been used to improve microcapsule mechanical stability and resistance to erosion. However, some compounds used are toxic and difficult to remove, limiting their application in food and making it unsafe. Thus, vegetable proteins are a relevant alternative because they are cheap, have low risk to human health, and have adequate techno-functional properties. However, they present challenges in terms of stability and strength. Despite the advances made, aspects still need to be addressed to improve the functional properties of these gels. Research continues to search for solutions that allow its safe and effective application in food.
Key words: proteins, gels, polysaccharides, food, microcapsules.
Resumo
Esta revisão estuda os sistemas de transporte de nutrientes e bioativos em alimentos por meio da formação de microcápsulas a partir de géis de proteínas-polissacarídeos. Apesar de promissores, possuem limitações e aspectos negativos que devem ser abordados. Um dos principais desafios é garantir a estabilidade das microcápsulas. As condições do processo tornam as misturas instáveis, afetando sua eficácia e solubilidade, o que resulta na liberação precoce de bioativos, deixando-os desprotegidos durante a passagem pelo trato gastrointestinal e no armazenamento. Técnicas de reticulação, gelificação a frio e modificação de superfície têm sido usadas para melhorar a estabilidade mecânica da microcápsula e a resistência à erosão. No entanto, alguns compostos utilizados são tóxicos e de difícil remoção, limitando sua aplicação em alimentos e tornando-os inseguros. Assim, as proteínas vegetais são uma alternativa relevante por serem baratas, apresentarem baixo risco à saúde humana e apresentarem propriedades tecnofuncionais adequadas. No entanto, eles apresentam desafios em termos de estabilidade e força. A pesar dos avanços obtidos, aspectos ainda precisam ser abordados para melhorar as propriedades funcionais desses géis. A investigação continua na procura de soluções que permitam a sua aplicação segura e eficaz em alimentos
Palavras chave proteínas, géis, polissacarídeos, alimentos, microcápsulas
Introducción
La demanda de alimentos saludables y funcionales ha aumentado considerablemente en los últimos años, impulsando la investigación en nuevas tecnologías para mejorar la calidad y la estabilidad de los productos alimenticios (Avelar et al., 2021). En este contexto, los geles formados por proteínas vegetales y polisacáridos han surgido como un sistema de transporte prometedor para una variedad de aplicaciones alimentarias (Nath et al., 2022). Estos geles presentan propiedades físicas y funcionales únicas que los hacen adecuados para retener, proteger y liberar compuestos bioactivos en el proceso de almacenamiento y digestión (Banerjee & Bhattacharya, 2012). Aunque se ha realizado una investigación significativa en este campo, una revisión narrativa breve puede proporcionar una visión integral y actualizada sobre el estado actual de los geles de proteínas vegetales y polisacáridos como sistemas de transporte en alimentos.
Las legumbres, cereales, semillas y nueces en general son una importante fuente de proteínas en la industria alimentaria y se utilizan habitualmente como ingredientes alimentarios; tienen un importante potencial comercial debido a su diversidad, sus diferencias en cuanto a propiedades físico-químicas, su importancia fundamental en la dieta humana y su composición en aminoácidos (K. K. Ma et al., 2022). Tienen las ventajas potenciales de su gran disponibilidad, bajo coste, baja toxicidad, biocompatibilidad, biodegradabilidad y de ser fácilmente modificables (Chen et al., 2006; Kumar et al., 2022; K. K. Ma et al., 2022). Además, las proteínas vegetales contribuyen a las propiedades sensoriales de los alimentos, aportan propiedades funcionales adecuadas, como emulsificación, gelificación, formación de espuma y capacidad de retención de agua, y son más baratas que las proteínas animales (Groβmann et al., 2021; Sze-Tao & Sathe, 2000). Principalmente, debido al elevado coste de las proteínas animales y a algunas preocupaciones de los consumidores sobre la transmisión de enfermedades animales ), las fuentes de proteínas vegetales son excelentes fuentes alternativas para satisfacer las necesidades nutricionales, así como los requisitos de las aplicaciones industriales (Chen et al., 2006). Las proteínas de leguminosas y cereales son las principales fuentes de proteínas vegetales. Actualmente, la soja constituye la fuente de proteína vegetal más importante en las fórmulas alimentarias (K. K. Ma et al., 2022). Sin embargo, el trigo, la cebada, el garbanzo, la lenteja y las arvejas, entre otros cereales, son materiales vegetales muy prometedores que poco a poco han comenzado a utilizarse como fuente de proteínas en la industria alimentaria debido a sus propiedades físicas (Samard & Ryu, 2019; Yildirim & Ekinci, 2022). Aunque el uso de proteínas vegetales tiene desafíos relacionados con la funcionalidad de las mismas debido a diversos factores como su composición aminoacídica y estructura molecular que modulan sus propiedades funcionales, por ejemplo, su solubilidad (Boye et al., 2010a). La naturaleza y las propiedades fisicoquímicas de las proteínas que componen la semilla, así como las diferencias en la composición bioquímica de las leguminosas y los cereales, pueden explicar en parte las diferentes tecnologías utilizadas en el tratamiento de los materiales vegetales. La técnica más utilizada para extraer las proteínas de las leguminosas es la extracción alcalina seguida de precipitación isoeléctrica (Boye et al., 2010a). La ultrafiltración es otra técnica, que se ha estudiado porque puede mejorar las propiedades funcionales y extraer eficientemente los factores antinutricionales (Boye et al., 2010b; Z. Ma et al., 2017; Mondor et al., 2009). Por otra parte, debido a la diferente composición aminoacídica de las proteínas de los cereales y las legumbres, sus proteínas se extraen comúnmente por el método de Osborne, que se aplica particularmente para cada uno de ellos y que depende de la solubilidad de las mismas (Agboola et al., 2005; Chanput et al., 2009).
La composición proteínica de las leguminosas es bastante similar y se compone principalmente de globulinas y albúminas, principalmente del tipo de proteínas 7S, 11S y 15S (Guerrieri, 2004) . A valores de pH comprendidos entre cuatro y cinco (punto isoeléctrico), estas proteínas presentan generalmente una solubilidad mínima. La solubilidad, las capacidades de retención de agua y de grasas, las propiedades espumantes y emulsionantes, el espesamiento y la formación de geles son algunas de las propiedades funcionales demostradas para estas proteínas que son de importancia en el procesado de alimentos (Boye et al., 2010b). Por otro lado, los cereales tienen una composición diferente. Suelen predominar las prolaminas y las glutelinas, aunque su proporción difiere; por ejemplo, el trigo y la cebada son ricos en prolaminas y glutelinas (Guerrieri, 2004) mientras que la avena y el arroz contienen un 70-80% de globulinas (Nitrayová et al., 2018); asimismo, el arroz contiene cantidades más elevadas de glutelinas que otros cereales (Chanput et al., 2009).
Los polisacáridos son macromoléculas formadas por la unión de monosacáridos, los cuales son unidades simples de azúcar. Estas moléculas se encuentran ampliamente distribuidas en la naturaleza y desempeñan un papel fundamental en diversas funciones biológicas y tecnológicas. Se pueden clasificar en dos categorías principales: homopolisacáridos, que están compuestos por un solo tipo de monosacárido, y heteropolisacáridos, que están compuestos por diferentes tipos de monosacáridos (Avelar et al., 2021).
Los polisacáridos se encuentran en una amplia variedad de fuentes naturales, como plantas, algas, bacterias y animales. Algunos ejemplos comunes de polisacáridos incluyen el almidón, la celulosa, la pectina, el quitosano y el ácido hialurónico (Coviello et al., 2007). Estos polisacáridos tienen estructuras químicas y propiedades físicas y funcionales únicas que los hacen adecuados para diversas aplicaciones. En términos de propiedades físicas, los polisacáridos suelen ser hidrofílicos, lo que significa que tienen una alta afinidad por el agua (Taylor et al., 2010). Esto les confiere la capacidad de formar geles, soluciones viscosas o películas en presencia de agua. Además, pueden exhibir propiedades reológicas, como la viscosidad y la elasticidad, que influyen en la textura y la estabilidad de los productos alimentarios y otros productos (Chan, 2011).
Desde el punto de vista funcional, los polisacáridos desempeñan diferentes roles en los sistemas biológicos y alimentarios. Por ejemplo, el almidón es una fuente de energía almacenada en las plantas y es una fuente importante de calorías en la dieta humana. La celulosa, por otro lado, forma la estructura principal de las paredes celulares de las plantas y es un componente esencial de la fibra dietética. Además, los polisacáridos pueden actuar como agentes gelificantes, estabilizantes, emulsionantes y espesantes en la industria alimentaria, mejorando la textura, la estabilidad y las propiedades sensoriales de los productos (Jones et al., 2010).
Las proteínas y los polisacáridos desempeñan un papel clave en la formación de estructuras y la estabilización de los sistemas alimentarios. Se pueden encontrar mezclas de ambos biopolímeros en los ingredientes de una amplia gama de coloides alimentarios. La estabilidad general y la textura de los coloides alimentarios que contienen mezclas de biopolímeros dependen no sólo de las propiedades funcionales de los ingredientes individuales, sino también de la naturaleza y la fuerza de las interacciones proteína-polisacárido (Gentile, 2020). Como heteropolímeros, la estructura de las proteínas se basa en 20 aminoácidos (Guerrieri, 2004)). Esta característica permite un enorme número de disposiciones secuenciales con una amplia gama de interacciones y reacciones químicas. En contraste, los polisacáridos sólo se estructuran en base a unos pocos monómeros, por ejemplo, la celulosa y el almidón sólo contienen glucosa. En los polisacáridos, el hidroxilo es el único grupo reactivo (Jones et al., 2010), mientras que las proteínas presentan una gran variedad de interacciones y reacciones químicas posibles; pueden participar en reacciones químicas a través de enlaces covalentes (péptido y disulfuro) e interacciones no covalentes (enlace iónico, de hidrógeno y de van der Waals). Además, se producen interacciones hidrofóbicas entre los grupos no polares de las cadenas de aminoácidos (Aguilera-Garrido et al., 2021).
Cuando se mezclan dos biopolímeros en solución, como un polisacárido y una proteína, pueden observarse las siguientes posibilidades: la interacción de los dos biopolímeros puede ser segregativa (los biopolímeros se repelen y se denominan incompatibles) o asociativa (los biopolímeros se atraen) (Gentile, 2020). Al mezclar proteínas y polisacáridos en solución, surgen fuerzas atractivas que dan lugar a la formación de complejos, por lo que los complejos proteína-polisacárido pueden ser solubles o dar lugar a una separación de fases agregativa. Por otra parte, se produce una incompatibilidad termodinámica si tanto la proteína como el polisacárido tienen la misma carga, lo que puede dar lugar a una separación segregativa de fases si la concentración del polímero es superior al límite de cosolubilidad (Wei & Huang, 2019).
Según Jones (2010) y otros autores, tales como, Bandyopadhyay & Gosh (2012), Gentile (2020), Turgeon et al. (2003), y, Wei & Huang (2019), las proteínas y las mezclas de polisacáridos pueden utilizarse para fabricar partículas de biopolímeros con una variedad de composiciones, estructuras y dimensiones diferentes, dependiendo de la naturaleza de los biopolímeros implicados y del principio de ensamblaje utilizado. Aunque se han elaborado con éxito muchos polímeros sintéticos como medios de microencapsulación biodegradables, los polímeros naturales como las proteínas vegetales siguen siendo agentes atractivos que se investigan ampliamente.
La combinación de proteínas vegetales y polisacáridos para formar geles es particularmente interesante debido a sus propiedades complementarias. Las proteínas vegetales, como la proteína de leguminosas, contienen aminoácidos esenciales y tienen la capacidad de formar estructuras entrelazadas que contribuyen a la textura y a la estabilidad de los geles (Nath et al., 2022). Por otro lado, los polisacáridos, como los obtenidos de fuentes naturales como las algas, poseen propiedades gelificantes y estabilizantes que mejoran las características físicas y reológicas de los geles (Ma et al., 2017).
Una de las principales aplicaciones de los geles de proteínas vegetales y polisacáridos es su uso como sistemas de transporte de compuestos bioactivos en alimentos (Mooranian et al., 2016). Estos compuestos, como antioxidantes, vitaminas y péptidos bioactivos, son reconocidos por sus beneficios para la salud (Campos-Vega et al., 2010; López-Barrios et al., 2014). Los geles pueden proteger estos compuestos de la degradación causada por factores externos, como el oxígeno, la luz y las enzimas, y facilitar su liberación controlada durante la digestión, mejorando así su disponibilidad biológica (Nath et al., 2022).
Además de su función como sistemas de transporte, los geles de proteínas vegetales y polisacáridos también pueden modificar la textura y la estabilidad de los alimentos. La formación de geles puede mejorar la viscosidad, la elasticidad y la firmeza de los productos alimenticios, lo que resulta en una experiencia sensorial agradable para los consumidores (Liu et al., 2019). Estas propiedades pueden ser especialmente beneficiosas en productos lácteos productos cárnicos y alimentos procesados que buscan reemplazar ingredientes de origen animal y mejorar la calidad general del producto (Rossow & Seiffert, 2014).
Aunque existen investigaciones significativas sobre los geles de proteínas vegetales y polisacáridos en la literatura científica, se considera necesaria una revisión narrativa breve para resumir y analizar de manera crítica los estudios relevantes a fin de proyectar futuras contribuciones necesarias para aumentar el acervo de conocimiento en este campo.
En esta revisión narrativa breve, se examinará la literatura existente sobre los geles de proteínas y polisacáridos como sistemas de transporte en alimentos. Se identificarán las diferentes proteínas vegetales y polisacáridos utilizados, los métodos de formación de geles y las principales interacciones involucradas en estos procesos. Se evaluarán los estudios clave que investigan las propiedades físicas y funcionales de estos geles, su capacidad para proteger y liberar compuestos bioactivos, así como su influencia en la textura y la estabilidad de los alimentos. Se presentarán las limitaciones actuales y las áreas de investigación futura. El objetivo es proporcionar una visión integral de los avances recientes en este campo y explorar las perspectivas futuras para la aplicación de los geles de proteínas vegetales y polisacáridos en la industria alimentaria.
Metodología
Se siguieron las directrices de PRISMA Extension for Scoping Reviews (PRISMA-ScR) [Tricco et al., 2018], con algunas modificaciones, considerando que el objeto de esta investigación es una revisión narrativa y no panorámica (Tricco et al., 2018). La metodología de revisión se eligió en función de la pregunta de investigación, que requirió una búsqueda en la literatura existente de las investigaciones sobre el tema (Munn et al., 2018). El proceso de revisión del alcance incorporó los siguientes pasos principales: 1) definir la pregunta de investigación, 2) identificar los estudios relevantes, 3) examinar y seleccionar los estudios y 4) resumir los estudios e informar.
Definición de la pregunta de investigación
La revisión narrativa tuvo como objetivo proporcionar respuesta a la pregunta: ¿cuáles son los principales hallazgos en relación a la investigación sobre los geles de proteínas-polisacáridos con potencial uso para el transporte de sustancias en alimentos publicados en la literatura científica entre los años 2005-2022?
Identificación de estudios relevantes
La búsqueda se realizó en 2bases de datos: Web of Science (WoS) y Scopus. La búsqueda en cada una se realizó usando una ecuación de búsqueda con operadores booleanos. Para todas las bases de datos se utilizó la ecuación:
TI=((proteins) AND (polysaccharides) AND (gels)))
Criterios de inclusión y exclusión
Se aplicaron límites de años entre 2005 y 2022 por ser el período de tiempo en que se han producido la mayor cantidad de estudios en este campo con base en proteínas vegetales, se excluyeron todos los estudios que no estaban en idioma inglés, por el bajo impacto internacional que tienen. Para ser incluidos, los artículos debían contener información relacionada con las interacciones producidas entre proteínas y polisacáridos en el contexto de formación de un gel preparado con fines de utilización para el transporte de bioactivos o sustancias similares en la industria alimentaria. Además, debían ser estudios hechos solo en base a proteínas vegetales.
Análisis y selección de estudios
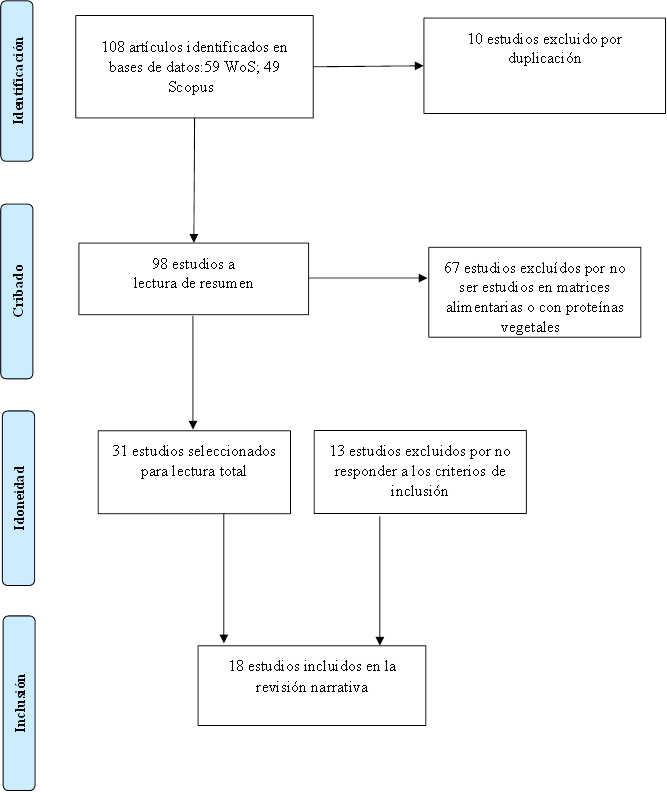
La búsqueda generó 108 resultados. Los manuscritos duplicados (10) fueron identificados y removidos manualmente. Los artículos restantes (98) fueron revisados en base a los criterios de inclusión y exclusión. Un total de 67 artículos fueron excluidos tras la revisión del título y el abstract. Los 31 manuscritos restantes fueron revisados leyéndolos en su totalidad y 13 fueron excluidos. Finalmente, un total de 18 documentos fueron seleccionados para ser incluidos en la revisión narrativa.
Resumen de los estudios y escritura de la revisión narrativa
Los estudios seleccionados fueron resumidos narrativamente y la información separada en dos grandes tópicos: i) Interacciones proteína-polisacáridos y ii) Sistemas de transporte en matrices alimentarias. Esta información se usó para redactar la revisión narrativa en la sección de resultados de este documento.
En la Figura 1 se resume el proceso de búsqueda y selección de los documentos incluidos en esta revisión narrativa y a continuación se presenta la información encontrada, resumida y separada en los tópicos generales más importantes.
Figura 1. Diagrama de flujo PRISMA que muestra el proceso de identificación, cribado (selección), idoneidad y estudios incluidos para la revisión narrativa.
![]()
Interacciones proteína-polisacárido
Las proteínas y los polisacáridos son componentes clave de los alimentos y pueden interactuar de diferentes formas. Las interacciones pueden involucrar enlaces químicos, como puentes de hidrógeno, enlaces iónicos y enlaces covalentes, así como interacciones no covalentes, como las fuerzas de Van der Waals y las interacciones hidrofóbicas. Estas interacciones pueden resultar en la formación de complejos proteína-polisacárido, que tienen un impacto directo en la estructura y funcionalidad de los sistemas alimentarios (Wei & Huang, 2019).
Las interacciones entre proteínas y polisacáridos juegan un papel fundamental en la formulación y estabilidad de muchos productos alimentarios. Estas interacciones, que pueden ocurrir tanto en estado líquido como en geles y sistemas de dispersión, tienen un impacto significativo en las características funcionales, texturales y reológicas de los alimentos. Comprender y controlar estas interacciones es esencial para optimizar la calidad de los productos y garantizar una experiencia sensorial satisfactoria para los consumidores (Turgeon et al., 2003). Estas interacciones proteína-polisacárido pueden influir en diversas propiedades de los alimentos, como la viscosidad, la estabilidad de la emulsión, la capacidad de retención de agua, la capacidad de gelificación y la textura. Por ejemplo, la interacción entre proteínas y polisacáridos puede formar una red tridimensional que afecta la consistencia y la firmeza de los productos alimentarios, como las salsas, los productos horneados y los productos cárnicos. Además, estas interacciones pueden proteger a las proteínas de la degradación en condiciones de procesamiento y almacenamiento, mejorando así la vida útil de los alimentos (Liu et al., 2019; Nath et al., 2022).
Por lo general, se produce una interacción termodinámica compatible entre las proteínas y los polisacáridos cuando se mezclan en un medio acuoso en condiciones específicas, como concentraciones relativamente bajas (<3 a 4 % en peso de sólidos totales), fuerzas iónicas bajas (<0,4 M) y cuando ambas moléculas tienen cargas eléctricas netas opuestas (Gentile, 2020; Jones et al., 2010; Turgeon et al., 2007). En la mezcla pueden formarse distintos tipos de estructuras en función de varios factores, como la afinidad de enlace proteína-polisacárido, la densidad de carga molecular y la conformación molecular (peso molecular, flexibilidad de la cadena y longitud del contorno). Estas estructuras son i)coacervados, ii)complejos o iii)geles (Aryee & Nickerson, 2014; de Oliveira et al., 2020; Gentile, 2020). Los coacervados pueden denominarse emulsiones líquido/líquido en las que las vesículas densas permanecen en estado líquido. Los complejos son agregados que pueden permanecer solubles o no en función de la carga que lleven. Los complejos solubles se forman en proporciones bajas de proteínas y polisacáridos, y a fuerzas iónicas moderadas. Los complejos insolubles o interpoliméricos son el resultado de una mayor proporción de proteínas en relación con los polisacáridos y de una mayor fuerza iónica (Bandyopadhyay & Gosh, 2012).
Cuando se mezclan más de un biopolímero gelificante, como proteínas y polisacáridos, se puede formar un gel mixto. Los geles se describen generalmente como una red interconectada de complejos (Rossow & Seiffert, 2014) y pueden dividirse en tres grupos: a) geles rellenos, b) geles mixtos y c) geles complejos (referencia). Los primeros, también denominados geles de fase separada, contienen una o varias redes independientes de biopolímeros que forman una fase continua rellena de partículas dispersas. Los geles de fase separada están formados por polímeros incompatibles, cuando las interacciones entre los diferentes polímeros son repulsivas y cuando los dos tipos de polímeros muestran una afinidad variable hacia el disolvente. Los geles mixtos están formados por dos (o más) redes independientes. También se denominan redes interpenetrantes. Las redes interpenetrantes se forman cuando los dos componentes gelifican por separado y forman redes independientes. Ambas redes son continuas en toda la muestra, pero cualquier interacción entre ellas es sólo topológica. Los geles complejos o acoplados implican la asociación directa entre los dos polímeros y la consiguiente formación de redes. Las redes de coacervados acoplados o complejos se forman en presencia de interacciones intermoleculares favorables entre los distintos tipos de polímeros (Banerjee & Bhattacharya, 2012; Nath et al., 2022).
Entre las principales ventajas de utilizar geles mixtos de proteínas y polisacáridos en la industria alimentaria en relación al transporte de biocompuestos está que pueden encapsular estos compuestos, como antioxidantes, vitaminas o péptidos, protegiéndolos de la degradación durante el procesamiento y almacenamiento. La degradación de estos biocompuestos se puede producir debido a la presencia de agentes como el oxígeno y la luz (Falsafi et al., 2022). Además, estos geles pueden liberar los compuestos de manera controlada en el momento adecuado, mejorando su biodisponibilidad y beneficios para la salud. Otros beneficios añadidos son: mejorar la textura y consistencia de los alimentos, conferir firmeza, elasticidad y viscosidad, mejorando la calidad sensorial de los productos, ayudar a retener y controlar la liberación de agua en los alimentos, lo que contribuye a la estabilidad y vida útil prolongada, y prevenir la separación de fases y la sinéresis en productos como yogures, salsas y postres. Esto último, porque los geles mixtos de proteínas y polisacáridos son compatibles con una amplia gama de ingredientes, lo que permite su aplicación en diversos productos alimentarios, tales como lácteos, productos cárnicos, productos horneados, aderezos, entre otros (Nitrayová et al., 2018; Samard & Ryu, 2019; Sarika & James, 2013; Sze-Tao & Sathe, 2000; Vrignaud et al., 2013).
Por otra parte, los geles mixtos pueden ser sensibles a cambios en el pH, temperatura y contenido de sales, lo que puede afectar su estabilidad y estructura, lo que puede provocar la ruptura del gel y la pérdida de las propiedades deseadas. Junto con esto, la reología de los geles mixtos puede ser complicada debido a la interacción entre las proteínas y los polisacáridos. Esto puede dificultar la predicción y el control de las propiedades viscoelásticas y reológicas del gel, lo que puede ser un desafío en la formulación de productos. Además, dependiendo de las características de los geles, como la concentración y la estructura, estos pueden presentar influencias en las propiedades sensoriales del alimento, como el sabor, el aroma y la apariencia. Estos cambios pueden ser deseables o indeseables según el tipo de producto y las preferencias del consumidor (Hwang & Shin, 2018; Nath et al., 2022; Vrignaud et al., 2013).
Sistemas de transporte en base a geles de proteína-polisacárido
Los sistemas de transporte de biocompuestos, basados en geles de proteína-polisacárido, han surgido como una tecnología prometedora en el campo de la ciencia de alimentos. Estos sistemas permiten la encapsulación y liberación controlada de compuestos bioactivos en diferentes matrices alimentarias, lo que abre nuevas oportunidades para mejorar la calidad, estabilidad y funcionalidad de los productos alimentarios (GroBmann et al., 2021). La combinación de proteínas y polisacáridos ofrece ventajas únicas en términos de compatibilidad, estabilidad y propiedades gelificantes, lo que los convierte en candidatos ideales para desarrollar sistemas de transporte eficientes y seguros. Se han desarrollado numerosas investigaciones sobre sistemas proteína-polisacárido para crear métodos de transporte de nutrientes y fármacos en los alimentos. Estos métodos se basan principalmente en sistemas de coacervados o complejos proteína-polisacárido utilizados para formar microcápsulas. La coacervación de complejos representa el método de elección para la encapsulación, dado que durante una separación de fases líquido/líquido, la fase coacervada puede formar espontáneamente una capa de recubrimiento alrededor del ingrediente activo suspendido o emulsionado en el medio de solución. La agitación permite limitar la sedimentación del coacervado y garantiza un recubrimiento homogéneo. Un hecho interesante es la carga de agente activo muy elevada, a veces de hasta el 99%, que puede obtenerse (Falsafi et al., 2022). Sin embargo, algunos aspectos relacionados con los coacervados o las técnicas basadas en complejos y el comportamiento de la microcápsula en algunas condiciones de procesamiento limitan su uso y presentan algunos aspectos negativos.
Una de las cuestiones más importantes es la estabilidad de las estructuras formadas. Liu et al., (2019), afirma que, en muchos sistemas de emulsión de modelo complejo, muchos estudios han demostrado el efecto desestabilizador del aumento de la viscosidad o del aumento de la relación proteína-polisacárido en mezclas que contienen proteínas globulares y polisacáridos aniónicos. En la técnica de secado por pulverización, muy utilizada para la microencapsulación de concentrados celulares probióticos recién preparados en diversas proteínas, la solubilidad en agua de las microcápsulas es un gran problema (Avramenko et al., 2016). Las células se liberan completamente en el producto en una fase demasiado temprana, por lo que no están protegidas de las condiciones adversas durante el almacenamiento del producto y el tránsito gastrointestinal (referencia). Además, las altas temperaturas durante el secado por pulverización suelen provocar un deterioro de las células, lo que se traduce en pérdidas significativas de células vivas y una menor resistencia frente a las siguientes condiciones ambientales adversas (Heidebach, Forst, & Kulozik, 2009).
Un aspecto relacionado con la estabilidad de las partículas es su resistencia en condiciones no favorables. Las partículas, pueden experimentar disociación cuando se alteran las condiciones ambientales, por ejemplo, cambiando el pH o aumentando la fuerza iónica (Jones et al., 2010). Con el fin de hacer que las partículas sean más resistentes, muchos estudios han modificado las técnicas de formación de partículas mejorando la estabilidad mecánica y la resistencia a la erosión en diferentes fluidos orgánicos utilizando altas temperaturas, reticulación por reacción de Maillard, disolventes orgánicos y otras sustancias químicas (Kumar et al., 2022). Por ejemplo, Vrignaud et al., (2013), desarrollaron un método de encapsulación "totalmente acuoso" para formar microesferas con gotas de proteína de suero encapsuladas por una capa de alginato. Gan et al. (2009), aumentaron la estabilidad de las microesferas de gel en saliva artificial y fluido gástrico simulado, a través de la modificación de la estructura de red de la matriz proteica mediante el tratamiento combinado con agentes reticulantes. Un agente reticulante comúnmente empleado como agente endurecedor es el glutaraldehído. Se ha utilizado en la preparación de microcápsulas de alginato cálcico (Badawy et al., 2017) así como para microcápsulas hechas de pectina (Hwang & Shin, 2018). Del mismo modo, se ha empleado alcohol isopropílico unido a glutaraldehído para endurecer y deshidratar microesferas de alginato cálcico (Chan, 2011). Sin embargo, las partículas pueden presentar una forma distorsionada y una aglutinación marcada al secarse en el horno. Esto demostró que tanto el glutaraldehído como el alcohol isopropílico no producen un endurecimiento adecuado de las microesferas, es decir, la formación correcta de una pared externa resistente a procesos físicos, químicos o enzimáticos posteriores (Chan, 2011; Tan et al., 2021). Además, los disolventes orgánicos como el glutaraldehído, que se utilizan para aumentar la resistencia de las microesferas mediante reticulación, son difíciles de eliminar en el producto final y están limitados por sus efectos tóxicos (Avelar et al., 2021).
La reticulación también puede formarse mediante la reacción de Maillard, que evita el uso de disolventes orgánicos. Gan et al. (2008), formaron microcápsulas mediante el método de coacervación seguido de un tratamiento combinado de reticulación utilizando transglutaminasa microbiana y ribosa. Sin embargo, las microcápsulas formadas presentaron formas irregulares o distorsionadas con una superficie ligeramente rugosa, poros y grietas en la superficie. La distorsión se debe posiblemente a la agregación de las matrices proteicas más que a la formación de una película continua y a la alta densidad de reticulación. Además, la reticulación de Maillard retrasa la liberación del núcleo porque evita la actividad enzimática de la pepsina, y a veces evita la liberación total del núcleo (Gan, Cheng, & Easa, 2008).
Casi todas estas modificaciones utilizan calor en algunas de las etapas de producción, disolventes orgánicos o componentes no aptos para uso alimentario, lo que limita el uso de las microcápsulas a componentes que soportan altas temperaturas o son para uso farmacéutico, por lo que los compuestos encapsulados sensibles pueden destruirse parcialmente, así como causar problemas de toxicidad asociados a residuos orgánicos (Chen & Subirade, 2007). Por lo tanto, los nuevos estudios buscan la seguridad mientras que mejoran la resistencia de las partículas en condiciones adversas y permiten el uso de técnicas en sistemas alimentarios con el fin de lograr mejores condiciones para los consumidores y las industrias alimentarias (Kumar et al., 2022; Ma et al., 2022).
En la búsqueda de solucionar algunas de estas limitaciones, Chen y Subirade (2007), desarrollaron una técnica de encapsulación denominada gelificación en frío, basada en el desarrollo de una matriz de gel a baja temperatura mediante la adición de cationes a una suspensión proteica precalentada. Estas microcápsulas son gastrorresistentes y forman buenas matrices para proteger moléculas bioactivas liposolubles. También se ha utilizado otro enfoque basado en la técnica de recubrimiento de microesferas de gel de alginato de calcio con otros polímeros, como proteínas, para producir partículas transportadoras. A este respecto, el quitosano, los derivados del quitosano y la poli-L-lisina se han utilizado como agentes modificadores típicos de la superficie(referencia). La superficie de la matriz de gel de alginato se modificó mediante estas macromoléculas, que son capaces de establecer interacciones iónicas con los iones carboxilato del alginato, formando así una envoltura alrededor de los sistemas de gel de alginato que, a su vez, se vuelven más resistentes y adecuados para numerosas aplicaciones (Coviello et al., 2007). Esta técnica es potencialmente muy prometedora para la administración de fármacos macromoleculares en aplicaciones biomédicas y biotecnológicas, pero, aunque el quitosano está considerado en la lista GRAS (“generalmente reconocido como seguro”) de la FDA (Food and Drugs Adminstration), no todos sus derivados lo están como ingredientes en alimentos. Otro ejemplo es el estudio de Mooranian et al., (2016), donde se crearon microcápsulas con una cubierta exterior formada por una multicapa de poli(clorhidrato de alilamina)/polisulfonato de estireno). En este estudio las microcápsulas mostraban el peculiar comportamiento de "atraer" macromoléculas cargadas positivamente al interior de su estructura (Mooranian et al., 2016).
Por otro lado, la gelificación de proteínas y polisacáridos es una técnica menos empleada. Los geles formados por proteína-polisacárido tienen una aplicación potencial como matriz de transporte(referencia). La principal distinción de este gel con otros geles que contienen proteínas es que puede formarse a concentraciones extremadamente bajas, y que la proteína del sistema se encuentra en estado "nativo", ya que no ha sido sometida a ningún proceso desnaturalizante (Turgeon & Laneuville, 2009). El método más empleado para formar micropartículas es la gelificación ionotrópica que consiste en mezclar proteínas y polisacáridos con diferente carga y que debido a las interacciones moleculares, formarán de forma natural una micropartícula(referencia). Algunos procesos exitosos de formación de partículas de microgel por este método son: tocotrienol en microcápsulas de quitosano y alginato (Tan et al., 2021), microesferas de proteína de suero bovino (BSP)/quitosano (Ma & Liu, 2010), de goma gellan/albúmina de huevo (Kulkarni, et al., 2010), nanopartículas de quitosano/goma arábica (Avadi, et al., 2010), microgel de caseína/almidón (Hu et al., 2021) y de zeina/κ carragenano (Liao et al., 2023). Algunas ventajas de este proceso es que es muy sencillo y suave, produciendo partículas de forma uniforme con una eficacia de atrapamiento relativamente alta (Zhang et al., 2017). También que se puede combinar con reticulación física reversible para evitar la posible toxicidad de los reactivos y otros efectos indeseables (Tsai et al., 2010). Sin embargo, un par de desventajas importantes son que puede exhibir corta estabilidad de almacenamiento, limitaciones en su estabilidad mecánica, baja reproducibilidad y estandarización del proceso de gelación, morfologías no uniformes o heterogéneas lo que afecta a las propiedades finales y rendimiento en aplicaciones específicas y tamaño de partículas muy grandes (superior a 100 µm) lo que puede impedir su uso en alimentos por producir cambios en las propiedades sensoriales (Sarika & James, 2013; Silva et al., 2007; Zhang et al., 2017).
Se han realizado algunas modificaciones de estas técnicas para evitar estos problemas, pero implican utilizar determinados procesos y compuestos, limitando el uso a componentes resistentes a altas temperaturas o para fines farmacéuticos. Adicionalmente, existen más estudios realizados usando proteínas animales que vegetales, lo que restringe su uso en alimentos para la población vegetariana o vegana, aumenta los riesgos para la salud humana y encarece el proceso en comparación a usar proteínas de origen vegetal. El uso de proteínas vegetales tiene desafíos relacionados con la funcionalidad de las mismas debido a la falta de algunos aminoácidos en su estructura primaria en comparación a las proteínas de origen animal, pero la investigación ha avanzado en este campo y existen diversas técnicas sencillas y cada vez más utilizadas que permiten su modificación a fin de mejorar sus propiedades funcionales y convirtiéndolas en una excelente alternativa para adaptar los sistemas de transporte (Kumar et al., 2022).
Conclusiones
Los sistemas de transporte basados en geles de proteína-polisacárido representan una estrategia innovadora y prometedora en el desarrollo de alimentos funcionales y saludables. Estos sistemas ofrecen ventajas en términos de encapsulación, protección y liberación controlada de compuestos bioactivos, lo que puede mejorar la calidad y funcionalidad de los productos alimentarios. El entendimiento de la formación y propiedades de estos geles es fundamental para su aplicación efectiva en la industria alimentaria, abriendo nuevas posibilidades para el desarrollo de alimentos con beneficios para la salud y una mayor satisfacción del consumidor. Una de las principales preocupaciones es la estabilidad de las estructuras formadas. Algunas mezclas de proteínas y polisacáridos pueden volverse inestables y desestabilizarse en ciertas condiciones, lo que afecta la eficacia de las microcápsulas. Además, en algunas técnicas de secado por pulverización, la solubilidad en agua de las microcápsulas es un problema, lo que puede resultar en la liberación temprana de los ingredientes activos y su falta de protección durante el almacenamiento y el paso por el tracto gastrointestinal. La utilización de geles mixtos de proteínas y polisacáridos ofrecen una serie de ventajas en términos de mejora de la textura, estabilidad, protección de compuestos bioactivos y versatilidad en aplicaciones alimentarias. Sin embargo, también es importante tener en cuenta las desventajas asociadas con la sensibilidad a condiciones extremas, la complejidad reológica, el costo y la posible interferencia con las propiedades sensoriales al considerar su uso en productos alimentarios específicos.
La resistencia de las partículas formadas a partir de geles de proteínas y polisacáridos en condiciones desfavorables también es un desafío. Se han utilizado diversas técnicas de reticulación y endurecimiento para mejorar la estabilidad mecánica y la resistencia a la erosión de las microcápsulas. Sin embargo, algunos de los agentes químicos utilizados en estos procesos, como el glutaraldehído y los disolventes orgánicos, pueden ser tóxicos y difíciles de eliminar, lo que limita su aplicación en sistemas alimentarios y plantea preocupaciones de seguridad. Similarmente si bien existen varias técnicas alternativas, como la gelificación en frío y la modificación de la superficie de las microcápsulas con otros polímeros, para abordar estas limitaciones, algunas de estas técnicas utilizan componentes no aptos para uso alimentario o implican procesos complejos y costosos, lo que restringe su aplicación en alimentos y dificulta su estandarización. En este aspecto, las ventajas del uso de proteínas vegetales, como un costo menor al de los animales, con bajos riesgos para la salud humana y con propiedades funcionales y tecnológicas adecuadas para las técnicas de producción, las hacen una importante alternativa en estos procesos. Ejemplos de proyecciones futuras son los estudios hechos en la sustitución de componentes cárnicos, lácteos y huevos en distintos alimentos (Akin & Ozcan, 2017; Asgar et al., 2010; De la Hera et al., 2012; Jarpa-Parra et al., 2017; Lin et al., 2017; Samard & Ryu, 2019).
Aunque existen avances en el desarrollo de sistemas proteína-polisacárido para el transporte de nutrientes y fármacos en alimentos, aún hay desafíos que deben abordarse en términos de estabilidad de las microcápsulas, resistencia en condiciones adversas, toxicidad de los compuestos utilizados y uso de proteínas de origen vegetal. La investigación continúa buscando soluciones que mejoren las propiedades funcionales de estas partículas y permitan su aplicación en sistemas alimentarios de manera segura y efectiva.
Conflicto de intereses
La autora declara no tener conflicto de intereses.
Referencias
Aguilera-Garrido, A., Del Castillo-Santaella, T., Yang, Y., Galisteo-González, F., Gálvez-Ruiz, M. J., Molina-Bolívar, J. A., Holgado-Terriza, J. A., Cabrerizo-Vílchez, M. Á., & Maldonado-Valderrama, J. (2021). Applications of serum albumins in delivery systems: Differences in interfacial behaviour and interacting abilities with polysaccharides. Advances in Colloid and Interface Science, 290, 102365. https://doi.org/10.1016/j.cis.2021.102365
Akin, Z., & Ozcan, T. (2017). Functional properties of fermented milk produced with plant proteins. LWT - Food Science and Technology. https://doi.org/10.1016/j.lwt.2017.07.025
Aryee, F. N. A., & Nickerson, M. T. (2014). Effect of pH, biopolymer mixing ratio and salts on the formation and stability of electrostatic complexes formed within mixtures of lentil protein isolate and anionic polysaccharides (κ-carrageenan and gellan gum). International Journal of Food Science & Technology, 49(1), 65-71. https://doi.org/10.1111/ijfs.12275
Asgar, M. A., Fazilah, A., Huda, N., Bhat, R., & Karim, A. A. (2010). Nonmeat protein alternatives as meat extenders and meat analogs. Comprehensive Reviews in Food Science and Food Safety, 9(5), 513-529. https://doi.org/10.1111/j.1541-4337.2010.00124.x
Avelar, Z., Vicente, A. A., Saraiva, J. A., & Rodrigues, R. M. (2021). The role of emergent processing technologies in tailoring plant protein functionality: New insights. Trends in Food Science & Technology, 113, 219-231. https://doi.org/10.1016/j.tifs.2021.05.004
Avramenko, N. A., Chang, C., Low, N. H., & Nickerson, M. T. (2016). Encapsulation of flaxseed oil within native and modified lentil protein-based microcapsules. Food Research International, 81, 17-24. https://doi.org/10.1016/j.foodres.2015.12.028
Badawy, M. E. I., Taktak, N. E. M., Awad, O. M., Elfiki, S. A., & El-Ela, N. E. A. (2017). Preparation and Characterization of Biopolymers Chitosan/Alginate/Gelatin Gel Spheres Crosslinked by Glutaraldehyde. Journal of Macromolecular Science, Part B, 56(6), 359-372. https://doi.org/10.1080/00222348.2017.1316640
Bandyopadhyay, P., & Gosh, A. K. (2012). Polysaccharide-Protein Interactions and Their Relevance in Food Colloids. En D. Karunaratne (Ed.), The Complex World of Polysaccharides. InTech. https://doi.org/10.5772/50561
Banerjee, S., & Bhattacharya, S. (2012). Food Gels: Gelling Process and New Applications. Critical Reviews in Food Science and Nutrition, 52(4), 334-346. https://doi.org/10.1080/10408398.2010.500234
Boye, J., Zare, F., & Pletch, A. (2010a). Pulse proteins: Processing, characterization, functional properties and applications in food and feed. Food Research International, 43(2), 414-431. https://doi.org/10.1016/j.foodres.2009.09.003
Boye, J., Zare, F., & Pletch, A. (2010b). Pulse proteins: Processing, characterization, functional properties and applications in food and feed. Food Research International, 43(2), 414-431. https://doi.org/10.1016/j.foodres.2009.09.003
Campos-Vega, R., Loarca-Pía, G., & Oomah, B. D. (2010). Minor components of pulses and their potential impact on human health. Food Research International, 43(2), 461-482. https://doi.org/10.1016/j.foodres.2009.09.004
Chan, E.-S. (2011). Preparation of Ca-alginate beads containing high oil content: Influence of process variables on encapsulation efficiency and bead properties. Carbohydrate Polymers, 84(4), 1267-1275. https://doi.org/10.1016/j.carbpol.2011.01.015
Chanput, W., Theerakulkait, C., & Nakai, S. (2009). Antioxidative properties of partially purified barley hordein, rice bran protein fractions and their hydrolysates. Journal of Cereal Science, 49(3), 422-428. https://doi.org/10.1016/j.jcs.2009.02.001
Chen, L., Remondetto, G. E., & Subirade, M. (2006). Food protein-based materials as nutraceutical delivery systems. Trends in Food Science and Technology, 17(5), 272-283. https://doi.org/10.1016/j.tifs.2005.12.011
Coviello, T., Matricardi, P., Marianecci, C., & Alhaique, F. (2007). Polysaccharide hydrogels for modified release formulations. Journal of Controlled Release, 119(1), 5-24. https://doi.org/10.1016/j.jconrel.2007.01.004
De la Hera, E., Ruiz-París, E., Oliete, B., & Gómez, M. (2012). Studies of the quality of cakes made with wheat-lentil composite flours. LWT - Food Science and Technology, 49(1), 48-54. https://doi.org/10.1016/j.lwt.2012.05.009
de Oliveira, W. Q., Wurlitzer, N. J., Araújo, A. W. de O., Comunian, T. A., Bastos, M. do S. R., de Oliveira, A. L., Magalhães, H. C. R., Ribeiro, H. L., de Figueiredo, R. W., & de Sousa, P. H. M. (2020). Complex coacervates of cashew gum and gelatin as carriers of green coffee oil: The effect of microcapsule application on the rheological and sensorial quality of a fruit juice. Food Research International, 131(October 2019). https://doi.org/10.1016/j.foodres.2020.109047
Falsafi, S. R., Rostamabadi, H., Samborska, K., Mirarab, S., Rashidinejhad, A., & Jafari, S. M. (2022). Protein-polysaccharide interactions for the fabrication of bioactive-loaded nanocarriers: Chemical conjugates and physical complexes. Pharmacological Research, 178, 106164. https://doi.org/10.1016/j.phrs.2022.106164
Gentile, L. (2020). Protein–polysaccharide interactions and aggregates in food formulations. Current Opinion in Colloid & Interface Science, 48, 18-27. https://doi.org/10.1016/j.cocis.2020.03.002
GroBmann, K. K., Merz, M., Appel, D., Thaler, T., & Fischer, L. (2021). Impact of Peptidase Activities on Plant Protein Hydrolysates Regarding Bitter and Umami Taste. Journal of Agricultural and Food Chemistry, 69(1), 368-376. https://doi.org/10.1021/acs.jafc.0c05447
Guerrieri, N. (2004). Cereal proteins. Proteins in Food Processing, 176-196. https://doi.org/10.1533/9781855738379.1.176
Hu, D., Zhang, Z., Yuan, L., Li, W., Guo, Y., Zhang, R., Yang, X., & Peng, H. (2021). Load phycocyanin to achieve in vivo imaging of casein-porous starch microgels induced by ultra-high-pressure homogenization. International Journal of Biological Macromolecules, 193, 127-136. https://doi.org/10.1016/j.ijbiomac.2021.10.127
Hwang, S. W., & Shin, J. S. (2018). Pectin-Coated Curcumin-Chitosan Microparticles Crosslinked with Mg 2+ for Delayed Drug Release in the Digestive System. International Journal of Polymer Science, 2018, 1-7. https://doi.org/10.1155/2018/2071071
Jarpa-Parra, M., Wong, L., Wismer, W., Temelli, F., Han, J., Huang, W., Eckhart, E., Tian, Z., Shi, K., Sun, T., & Chen, L. (2017). Quality characteristics of angel food cake and muffin using lentil protein as egg/milk replacer. International Journal of Food Science & Technology, 52(7), 1604-1613. https://doi.org/10.1111/ijfs.13433
Jones, O. G., Lesmes, U., Dubin, P., & McClements, D. J. (2010). Effect of polysaccharide charge on formation and properties of biopolymer nanoparticles created by heat treatment of ??-lactoglobulin-pectin complexes. Food Hydrocolloids, 24(4), 374-383. https://doi.org/10.1016/j.foodhyd.2009.11.003
Kumar, M., Tomar, M., Potkule, J., Reetu, Punia, S., Dhakane-Lad, J., Singh, S., Dhumal, S., Chandra Pradhan, P., Bhushan, B., Anitha, T., Alajil, O., Alhariri, A., Amarowicz, R., & Kennedy, J. F. (2022). Functional characterization of plant-based protein to determine its quality for food applications. Food Hydrocolloids, 123, 106986. https://doi.org/10.1016/j.foodhyd.2021.106986
Liao, M., Zhang, R., Zhou, Y., Xu, D., Han, Y., Liu, F., Su, J., & Chen, S. (2023). Preparation and characterization of particle-filled microgels by ion induction based on zein and κ-carrageenan for delivering the CoQ10. Food Hydrocolloids, 142, 108774. https://doi.org/10.1016/j.foodhyd.2023.108774
Lin, M., Tay, S. H., Yang, H., Yang, B., & Li, H. (2017). Replacement of eggs with soybean protein isolates and polysaccharides to prepare yellow cakes suitable for vegetarians. Food Chemistry, 229, 663-673. https://doi.org/10.1016/j.foodchem.2017.02.132
Liu, Y., Zhang, W., Wang, K., Bao, Y., Regenstein, J. M., & Zhou, P. (2019). Fabrication of Gel-Like Emulsions with Whey Protein Isolate Using Microfluidization: Rheological Properties and 3D Printing Performance. Food and Bioprocess Technology, 12(12), 1967-1979. https://doi.org/10.1007/s11947-019-02344-5
López-Barrios, L., Gutiérrez-Uribe, J. A., & Serna-Saldívar, S. O. (2014). Bioactive Peptides and Hydrolysates from Pulses and Their Potential Use as Functional Ingredients: Potential functional use of pulses. Journal of Food Science, 79(3), R273-R283. https://doi.org/10.1111/1750-3841.12365
Ma, K. K., Greis, M., Lu, J., Nolden, A. A., McClements, D. J., & Kinchla, A. J. (2022). Functional Performance of Plant Proteins. Foods, 11(4), 594. https://doi.org/10.3390/foods11040594
Ma, Z., Boye, J. I., & Hu, X. (2017). In vitro digestibility, protein composition and techno-functional properties of Saskatchewan grown yellow field peas (Pisum sativum L.) as affected by processing. Food Research International, 92, 64-78. https://doi.org/10.1016/j.foodres.2016.12.012
Mondor, M., Aksay, S., Drolet, H., Roufik, S., Farnworth, E., & Boye, J. I. (2009). Influence of processing on composition and antinutritional factors of chickpea protein concentrates produced by isoelectric precipitation and ultrafiltration. Innovative Food Science and Emerging Technologies, 10(3), 342-347. https://doi.org/10.1016/j.ifset.2009.01.007
Mooranian, A., Negrulj, R., Al-Salami, H., Morahan, G., & Jamieson, E. (2016). Designing anti-diabetic β-cells microcapsules using polystyrenic sulfonate, polyallylamine, and a tertiary bile acid: Morphology, bioenergetics, and cytokine analysis. Biotechnology Progress, 32(2), 501-509. https://doi.org/10.1002/btpr.2223
Nath, P. C., Debnath, S., Sridhar, K., Inbaraj, B. S., Nayak, P. K., & Sharma, M. (2022). A Comprehensive Review of Food Hydrogels: Principles, Formation Mechanisms, Microstructure, and Its Applications. Gels, 9(1), 1. https://doi.org/10.3390/gels9010001
Nitrayová, S., Brestenský, M., & Patráš, P. (2018). Comparison of two methods of protein quality evaluation in rice, rye and barley as food protein sources in human nutrition. Potravinarstvo Slovak Journal of Food Sciences, 12(1), 762-766. https://doi.org/10.5219/991
Rossow, T., & Seiffert, S. (2014). Supramolecular polymer gels with potential model-network structure. Polymer Chemistry, 5(8), 3018-3029. https://doi.org/10.1039/C3PY01692G
Samard, S., & Ryu, G. (2019). Physicochemical and functional characteristics of plant protein‐based meat analogs. Journal of Food Processing and Preservation, 43(10). https://doi.org/10.1111/jfpp.14123
Sarika, P. R., & James, N. R. (2013). Polysaccharides for colon targeted drug delivery. Drug Delivery, 20(5), 191-202. https://doi.org/doi: 10.3109/10717544.2013.845313
Silva, S. S., Mano, J. F., & Reis, R. L. (2007). Smart thermoresponsive coatings and surfaces for tissue engineering: Switching cell-material boundaries. Trends in Biotechnology, 25(12), 577-583. https://doi.org/doi: 10.1016/j.tibtech.2007.09.009
Sze-Tao, K. W. C., & Sathe, S. K. (2000). Functional properties and in vitro digestibility of almond (Prunus dulcis L.) protein isolate. Food Chemistry, 69(2), 153-160. https://doi.org/10.1016/S0308-8146(99)00244-7
Tan, P. Y., Tan, T. B., Chang, H. W., Mwangi, W. W., Tey, B. T., Chan, E. S., Lai, O. M., Liu, Y., Wang, Y., & Tan, C. P. (2021). Pickering emulsion-templated ionotropic gelation of tocotrienol microcapsules: Effects of alginate and chitosan concentrations and gelation process parameters. Journal of the Science of Food and Agriculture, 101(14), 5963-5971. https://doi.org/10.1002/jsfa.11249
Taylor, P., Schmitt, C., Sanchez, C., Desobry-banon, S., Hardy, J., Schmitt, C., Sanchez, C., Desobry-banon, S., & Hardy, J. (2010). Critical Reviews in Food Science and Nutrition Structure and Technofunctional Properties of Protein- Polysaccharide Complexes: A Review Structure and Technofunctional Properties of Protein-Polysaccharide Complexes: A Review. August 2014, 37-41. https://doi.org/10.1080/10408699891274354
Tricco, A. C., Lillie, E., Zarin, W., O’Brien, K. K., Colquhoun, H., Levac, D., Moher, D., Peters, M. D. J., Horsley, T., Weeks, L., Hempel, S., Akl, E. A., Chang, C., McGowan, J., Stewart, L., Hartling, L., Aldcroft, A., Wilson, M. G., Garritty, C., … Straus, S. E. (2018). PRISMA Extension for Scoping Reviews (PRISMA-ScR): Checklist and Explanation. Annals of Internal Medicine, 169(7), 467-473. https://doi.org/10.7326/M18-0850
Turgeon, S. L., Beaulieu, M., Schmitt, C., & Sanchez, C. (2003). Protein – polysaccharide interactions: Phase-ordering kinetics, thermodynamic and structural aspects. 8, 401-414.
Turgeon, S. L., Schmitt, C., & Sanchez, C. (2007). Protein – polysaccharide complexes and coacervates. 12, 166-178. https://doi.org/10.1016/j.cocis.2007.07.007
Vrignaud, S., Anton, N., Passirani, C., Benoit, J.-P., & Saulnier, P. (2013). Aqueous core nanocapsules: A new solution for encapsulating doxorubicin hydrochloride. Drug Development and Industrial Pharmacy, 39(11), 1706-1711. https://doi.org/10.3109/03639045.2012.730526
Wei, Z., & Huang, Q. (2019). Assembly of Protein–Polysaccharide Complexes for Delivery of Bioactive Ingredients: A Perspective Paper. Journal of Agricultural and Food Chemistry, 67(5), 1344-1352. https://doi.org/10.1021/acs.jafc.8b06063
Yildirim, E., & Ekinci, M. (2022). Vegetable Crops: Health Benefits and Cultivation. BoD – Books on Demand.
Zhang, Y., Ma, G., Song, C., & Mu, B. (2017). Ionotropic gelation of biopolymer for biomedical applications. Procedia Engineering, 174, 1278-1285. https://doi.org/doi: 10.1016/j.proeng.2017.01.288